Поиск по сайту
Наш блог
Это странная ситуация: вы соблюдали все меры предосторожности COVID-19 (вы почти все время дома), но, тем не менее, вы каким-то образом простудились. Вы можете задаться...
Как диетолог, я вижу, что многие причудливые диеты приходят в нашу жизнь и быстро исчезают из нее. Многие из них это скорее наказание, чем способ питаться правильно и влиять на...
Овес-это натуральное цельное зерно, богатое своего рода растворимой клетчаткой, которая может помочь вывести “плохой” низкий уровень холестерина ЛПНП из вашего организма....
Если вы принимаете витаминные и минеральные добавки в надежде укрепить свое здоровье, вы можете задаться вопросом: “Есть ли лучшее время дня для приема витаминов?”
Ты хочешь жить долго и счастливо. Возможно, ты мечтал об этом с детства. Хотя никакие реальные отношения не могут сравниться со сказочными фильмами, многие люди наслаждаются...
Приседания и выпады-типичные упражнения для укрепления мышц нижней части тела. Хотя они чрезвычайно распространены, они не могут быть безопасным вариантом для всех. Некоторые...

Ученые из Стэнфордского университета разработали программу предсказывающую смерть человека с высокой точностью.

Глава Минздрава РФ Вероника Скворцова опровергла сообщение о падении доходов медицинских работников в ближайшие годы. Она заявила об этом на встрече с журналистами ведущих...

Федеральная служба по надзору в сфере здравоохранения озвучила тревожную статистику. Она касаются увеличения риска острой кардиотоксичности и роста сопутствующих осложнений от...

Соответствующий законопроект внесен в палату на рассмотрение. Суть его заключается в нахождении одного из родителей в больничной палате бесплатно, в течении всего срока лечения...

- Категория: Система RH
К часто встречающимся относят антигены Rh, частота которых составляет более 99 %. Насчитывают 10 частых антигенов: Нгб, Hr, Rh total, HrB, C-like, Nou, Sec, Dav, MAR и CEST.
MAR (Rh51)
В 1994 г. Sistonen и соавт. [617] обнаружили очень редкие антитела, которые выявляли один из широко распространенных антигенов, названный MAR и получивший номер Rh51. Сыворотка реагировала со всеми образцами эритроцитов независимо от сочетания антигенов резус и других антигенных систем, за исключением образцов Cw+, Сх+, -D- и Rh null
При обследовании 8 семей авторы установили, что MAR-отрицательные лица имели антиген Cw или антиген Сх, а MAR-положительные - этих антигенов не содержали. Иными словами, при наличии гена, кодирующего продукцию антигена С^ши антигена Сх, отсутствует продукция антигена Rh51 и, наоборот, при наличии гена, кодирующего продукцию антигена Rh51, отсутствует продукция антигенов Cw и Сх. Полученные данные позволили авторам убедительно аргументировать оригинальный вывод о том, что антиген MAR находится в антитетичной связи сразу с двумя антигенами: Cw и Сх.
0'Shea и соавт. [516] описали 52-летнюю женщину DCwe/DCwe, у которой в результате множественных трансфузий в связи с несколькими операциями на сердце образовались антитела анти-с, анти-Е и анти-Лс(а). Элюат, снятый с эритроцитов c~E-Jk(a-) после контакта их с сывороткой женщины, агглютинировал эритроциты c-E-Jk(a-), DCxe, DCwCxe, но не реагировал с эритроцитами Rhnull, DCW-, Dc-. Поскольку ее эритроциты не реагировали с оригинальной сывороткой анти-MAR, авторы пришли к заключению, что дополнительные антитела, выработавшиеся у женщины, являются анти-МАЯ-подобными. Специфичность этих антител не могла быть признана как анти-MAR, так как некоторые MAR-отрицательные эритроциты очень слабо, но все же реагировали с элюатом. Оригинальная сыворотка анти-MAR была получена от женщины DCwe/DCxe и не реагировала с эритроцитами лиц DCwe/DCwe, DCwe/DCxe и DCxe/DCxe. AHTH-MAR-подобные антитела, полученные от человека DCwe/DCwe, являются первым и пока единственным случаем.
AHTH-MAR-антитела обладают дозозависимым эффектом, проявляющимся в более слабой реакции с эритроцитами гетерозигот Cw и Сх, чем гомозигот Cw/Cw и Сх/Сх [617].
Как считает Schenkel-Brunner [597], эпитопы Rh51 ассоциированы с заменами Ala 36 и Gin 41. Другие авторы придерживаются иного мнения. Issitt и Anstee [374] полагают: поскольку замены аминокислот, приводящие к экспрессии Cw и Сх, находятся в разных точках полипептида СЕ (т. е. Cw и Сх не являются аллелями), аллельность локусов RH51 и Cw, Сх, как и антитетичная взаимосвязь этих антигенов, остается недоказанной. Если бы детерминанта MAR включала аланин 36 и глютамин 41, детерминанта Cw - аланин 36 и аргинин 41, а детерминанта Сх - треонин 36 и глютамин 41, то можно было бы сделать вывод, что указанные три антигена являются продуктами аллелей.
Исследование указанных фенотипов на молекулярном уровне, несомненно, даст интересные результаты.
Rh total (Rh29)
Антиген Rh29, описанный как «total Rh», относится к широко распространенным антигенам. Он встречается у всех людей независимо от их резус-принадлежности, в том числе у лиц с редкими фенотипами, обусловленными делецией генов RH: -D-, cD-, *D* и др. Исключение составляют лица Rhnull, которые не содержат антигена Rh29 и в связи с этим могут вырабатывать соответствующие антитела.
Антитела aHra-Rh29 обнаружены Bar-Shany и соавт. [153] и другими исследователями [492] у лиц Rhnull, которые более чувствительны к стимуляции Rh-антигенами, чем люди с обычными Rh-фенотипами. Анти-1У129-антитела явились следствием переливаний крови [492] и беременности [153]. Описано несколько случаев анти-Я1129-антител, вызвавших посттрансфузионные осложнения и ГБН.
Badon и соавт. [150] наблюдали 87-летнюю пациентку, которую готовили к операции по поводу перелома бедра. Женщина имела группу крови 0(1) Rhnul|.
В ее сыворотке присутствовали антитела, идентифицированные как анти-ЯЬ29. Поскольку совместимую кровь в пределах США найти не удалось, в связи с прогрессирующей анемией женщине перелили 2 дозы крови 0(1) Rh-. Через 3 суток после переливания больная погибла. По заключению специалистов смерть наступила в результате сердечной недостаточности, усугубленной гемолизом. Авторы относят анти-111129-антитела к клинически значимым и считают, что трансфузии крови лицам RhnulI представляют угрозу жизни, особенно у ослабленных больных. Авторы ставят вопрос о расширении международного регистра редких доноров с целью обеспечения таких больных совместимой кровью.
Rh ауто (Rh39)
Необычность этого антигена состоит в том, что он выявлен с помощью ау-тоантител. В 1979 г. Issitt, Pavone и Shapiro [375] нашли 2 сыворотки с аутоан-тителами, которые поначалу были расценены как аллогенные анти-С, поскольку содержались у лиц С-. Однако при адсорбции - элюции обнаружилось, что они взаимодействуют с эритроцитами любого Rh-фенотипа, включая фенотипы Rh-делеций (-D- и Dc-).
Аутоантитела сравнили с антителами анти-Се (rh.), анти-G, анти-Нго, анти-Нг, анти-С, анти-LW, aHTH-Rh29, anra-Rh34, анти-U, и было показано, что они существенно отличаются.
Поскольку использованные для адсорбции эритроциты с Rh-делецией были Hr-Hro+HrB-, авторы заключили, что аутоантитела реагируют с антигеном, подобным Rh total (Rh29), но не идентичным ему. Этот антиген получил обозначение Rh39. Он присутствует на эритроцитах всех людей, за исключением эритроцитов Rh 1Г AHTH-Rh39-aHTm^a аллоиммунного происхождения не описаны.
Dav и Nou
Изучение образцов крови 2 женщин, миссис Helen Dav и миссис Nou, проведенное разными авторами (Contreras и соавт. [236,237], Daniels [243], Habibi и соавт. [334], Delehanty и соавт. [257]), позволило обнаружить 2 новых широко распространенных антигена, получивших обозначения Dav (Rh47) и Nou (Rh44).
Миссис Dav имела генотип *D*/*D*9 миссис Nou - генотип DIV(C)-/DIV(C)-. Эритроциты женщин неодинаково реагировали с сыворотками других лиц, имевших Rh-делеции. Эритроциты Dav+ реагировали только с 4 из 25 сывороток от аллоиммунизированных лиц -D-, Dc-, DCW- и Rhnull. Эритроциты Nou+ также реагировали с этими 4 сыворотками. После адсорбции эритроцитами Dav+ сыворотки утрачивали способность агглютинировать эритроциты Dav+, но продолжали агглютинировать эритроциты Nou+. Адсорбция сывороток эритроцитами Nou+ истощала активность сывороток по отношению к обоим антигенам. Таким образом, миссис Dav имела эритроциты Dav+Nou-, а миссис Nou | эритроциты
Nou+^Путем последовательной адсорбции сывороток эритроцитами, содержащими (и не содержащими) редкие антигены Evans, RHar, Goa, Riv и частые антигены Hro, Нг, Нгв, было показано, что антитела анти-Dav и анти-Nou представляют собой ранее неизвестные антитела, реагирующие с разными антигенами. Антитетичных по отношению к Dav и Nou антигенов не найдено.
Нг и Нг
Резус-антитела, продуцируемые лицами -D-, Dc-, DCW-, DIV(C)- и Rhnull, существенно отличаются от антител, продуцируемых людьми с обычным, без Rh-делеций, фенотипом: cde, CDe или cDE. Если обычные сыворотки антирезус содержат моно- или диспецифические антитела, то сыворотки лиц с делециями RH-теяов содержат, как правило, полиспецифические резус-антитела, отдельные фракции которых реагируют с общими антигенами, содержащимися во всех эритроцитах Rh+ и Rh-, за исключением фенотипов делеций [186, 327, 556, 593].
Два из этих общих часто встречающихся антигенов получили обозначение Hro(Rhl7) и Hr (Rhl8). Считается, что антиген Нг экспрессирован на эритроцитах, которые лишены некоторых эпитопов антигена Нго, подобно антигенам Dw, BARC, Evans, которые встречаются на эритроцитах DVa, D^, Divb, лишенных определенных D-эпитопов (см. табл. 4.14).
Антитела анти-Нго и анти-Hr выделяют из полиспецифических сывороток, очищая их от других антител адсорбцией эритроцитами, содержащими Rh-антигены в различных комбинациях, но при условии, что одни из них имеют антиген Нго, а другие не имеют.
В частности, эритроциты миссис Шабалала, имевшей фенотип е+Нг +Нг- hrs-, адсорбировали анти-Нго-антитела из сывороток аллоиммунизированных лиц -D-/-D-, но оставляли неадсорбировнными другие антитела почти идентичной специфичности, названные Shapiro [606] анти-Нг.
Как полагают многие исследователи, названия анти-Нг и анти-Нго в реальности отражают 2 группы антител близкой, но не идентичной специфичности. Антигены Нг и Нго тесно связаны друг с другом, а также с антигенами Е и е. Некоторые исследованные сыворотки анти-Нг/Нго содержали антитела анти-Е или анти-е, однако адсорбция эритроцитами Е-е+ и Е+е- соответственно удаляла анти-е и анти-Е-активность. Некоторые антитела анти-Нг и анти-Нго лучше реагировали с эритроцитами Е+, другие - с эритроцитами е+. Более поздние наблюдения обнаружили отсутствие эпитопов е и Нго на эритроцитах людей с некоторыми делециями RH-rem.
Проведено сравнение адсорбционной емкости эритроцитов разных фенотипов Rh в отношении антител анти-Нг/Нго. Оказалось, что эритроциты cde адсорбируют антител больше, чем CDe, а эритроциты CDe - больше, чем CDE. Очевидно, что эритроциты Rh- содержат большее количество антигенов Нг и Нг^ чем Rh-h Отсюда следует вывод: антигены Нг и Нго в большей мере кодиру-НиЁ^юм RHCE, чем RHD.
HrB (Bastiaan)
В 1972 г. Shapiro, Roux и Brink [607] описали сыворотку женщины, миссис Bastiaan. Сыворотка агглютинировала все образцы эритроцитов, за исключением собственных. Антитела, сохранившиеся после адсорбции сыворотки эритроцитами cDE/cDE, названы авторами анти-hr8 (см. hrB), а совокупная специфичность антител сыворотки миссис Bastiaan, по предложению Rosenfield, Allen, Rubinstein [570], была обозначена анти-Нгв. Антиген получил обозначение HrB (Rh34). Issitt, Pavone и Shapiro [375] показали, что у лиц с делециями ЛЯ-генов этот антиген на эритроцитах отсутствует. Антитела анти-Нгв обнаружены Hackel [335] у лиц -D-. Сыворотки анти-Нгв содержат трудносепарируе-мые антитела анти-Нгв + анти-hr8.
- Категория: Система RH
К редко встречающимся относят антигены, частота которых в популяции ниже 1 %. Таких антигенов насчитывают 23 (см. табл. 4.1 и 4.26): Сх, V, Ew, VS, СЕ, Dw, hrH, Goa, RN, RoHar, Bea, Evans, Tar, Ces, Craw, Riv, JAL, STEM, ¥PTT9 BARC, JAHK, HOFM и LOCR. Семнадцать из них описаны в предыдущих разделах как маркеры парциальных D-антигенов, варианты или сателлиты антигенов С, Е, V, VS и г/иоантигенов. Приводим антигены, не упоминавшиеся выше.
Веа (Rh36)
В литературе описаны 4 случая обнаружения антител анти-Веа (Davidsohn, Stern и соавт. [255], МсСгеагу и соавт. [469], Ducos и соавт. [цит. по 544], Clark и соавт. [Joint Cong. ISBT/AABB, 1990, 81]), явившихся причиной гемолитической болезни новорожденных. Носительницами анти-Веа-антител были Женщины CDe/CDe, cDe/cde и cDE/cde, чьи мужья были cde/cde.
Stern, Davidsohn и соавт. [628] получили аллоиммунные антитела анти-Веа, проиммунизировав 2 добровольцев (CDe/CDe и cde/cde) эритроцитами мужа одной из упомянутых выше женщин (миссис Berrens), у которой впервые были найдены анти-Веа-антитела. С помощью полученных сывороток исследовано более 25 тыс. доноров разных национальностей, но среди них не обнаружено носителей антигена Веа. Лишь 20 лет спустя, после того как МсСгеагу и соавт. [469] описали второй случай анти-Веа-антител, было выявлено несколько лиц Веа+.
Антиген Веа, как было установлено Race и Sanger [544], является частью системы Rh. Он присутствует у лиц с фенотипом (c)d(e)(f), у которых антигены с, е и f (се) слабо выражены. Обследование представителей 3 поколений 1 семьи показало, что генный комплекс, кодирующий фенотип (c)d(e)(f) Веа+, передается по наследству.
Антиген Веа встречается не у всех людей (c)d(e)(f). Часть лиц имеют фенотип (c)d(e)(f)Bea-, что указывает на возможность существования как минимум двух генов (c)d(e), один из которых кодирует выработку антигена Веа, а другой - нет.
Описан ген rL (cLowde) [475], обусловливающий низкую экспрессию антигенов с и е, но в отличие от гена Веанормальную экспрессию антигена f (се).
Craw (Rh43)
Антиген Craw (Crawford), обнаруженный в 1980 г. Cobb [230], встречается у негров с частотой ОД %. Он чаще присутствует у лиц с фенотипом Cdes, но имеются и исключения. До настоящего времени описан только 1 случай aHra-Craw-антител.
HOFM
Антиген HOFM описан в 1990 г. Hoffman и соавт. [351]. Антитела анти-HOFM явились причиной умеренной ГБН. Эритроциты HOFM+ характеризуются сниженной экспрессией антигена С; другие антигены Rh без изменений.
LOCK (Rh55)
Антиген LOCR обнаружен Coghlan и соавт. [231] в 1994 г. Носители антигена LOCR имеют уменьшенную экспрессию антигена с или е. В 3 обследованных семьях ген LOCR наследовался с гаплотипом cde.
Coghlan и Zelinski [232] исследовали хромосому 1 у 19 членов одной из этих семей и установили, что антиген LOCR является частью системы Rh.
JAL (Rh48)
Редко встречающийся антиген JAL найден и изучен Lomas [447] и Poole с со- л авт. [535] в 2 семьях. Этот антиген присутствует в эритроцитах европейцев, имеющих фенотип (C)D(e). У негров антиген JAL ассоциирован с фенотипом (c)D(e). Среди 90 ООО обследованных швейцарских доноров только 4 были JAL+.
JAHK (Rh53)
Green и соавт. [311] описали редко встречающийся антиген JAHK, выявляемый антителами, присутствующими в некоторых поливалентных сыворотках. Антиген JAHK официально признан как составная часть системы резус. Предполагается, что его продукция кодируется геном rG.
Daniels [245] нашел, что ген rG является аллелем гена се, в котором часть экзона 2 содержит эквивалентные сегменты гена D. Как полагает автор, аминокислотная последовательность, кодируемая геном rG, обусловливает продукцию антигена JAHK, который расположен на 2-й экстрацеллюлярной петле Rh-полипептида.
DАК (Rh54)
В 2003 г. Reid и соавт. [559] описали редко встречающийся антиген DAK, который присутствовал в 31 образце эритроцитов, содержащих парциальный антиген DIIIa, и в 5 образцах эритроцитов, содержащих антиген DOL. Антиген DAK выявляли также на эритроцитах с фенотипом RN (10 образцов) и эритроцитах, имеющих комбинацию антигенов STEM и S (1 образец). При других комбинациях антигенов резус антиген DAK отсутствовал. Реагирование с эритроцитами DIIIa и DOL было сильнее, чем с эритроцитами RN. Авторы пришли к выводу, что антиген DAK сильнее выражен на эритроцитах DIIIa и DOL, чем на эритроцитах RN. Антиген DAK, получивший номер ISBT Rh54, был обнаружен у 4 % доноров африканского происхождения, проживающих в Нью-Йорке.
Редкий антиген 01а обнаружен Kornstad [396]. Он встречается на эритроци-ах с ослабленной экспрессией антигенов С, с, е и Е и некоторым ослаблением антигена D. Антиген 01а получил обозначение как серия 700043 ISBT, однако вскоре было выяснено, что он не кодируется локусом RH и к системе Rh не относится (см. Система RHAG).
CENR (Rh56)
В 1998 г. Reid и соавт. [558] описали 2 образца комбинированных антител анти-Dw +aHTH-Rh32, которые не удавалось разделить перекрестной адсорбцией эритроцитами Dw+Rh32- и Dw-Rh32+.
В 2004 г. эти же авторы сообщили, что эритроциты больного с генотипом DCw(e)/D~, имевшего фенотип Rh:-23,-32 (не содержавшие антигенов Dw и Rh32), взаимодействовали с указанными комбинированными антителами. Антиген, открываемый ими, получил обозначение CeNR. Молекулярно-генетическое обследование CeNR-положительных лиц выявило новый гибридный гаплотип Ce(l-5)-D(6-10). Незадолго до этого было установлено, что этот гибридный ген кодирует также антиген Cw, экспрессия антигенов Сие ослаблена (Westhoff и соавт. [704]). В 2005 г. новый антиген, получивший название CENR, был включен в систему под номером Rh56 (Issitt [372]).
Как показали Beckers и соавт. [158, 160], Roulliac и соавт. [581, 582], аминокислотные замены, проявляющие себя в виде фенотипов DVa, Rh32+, Rh33+ и DBT, обусловлены конверсиями генов D и СЕ в экзонах 4 и 5. Они приводят к появлению на полипептидах RHD и RHCE цепей с новыми, необычными последовательностями аминокислот. Эти фрагменты белковых цепей иммуноген-ны и способны стимулировать образование специфически распознающих их антител. Детальное изучение специфичности антител с эритроцитами редких фенотипов позволило выявить качественные различия антигенов Dw, Rh32, Rh33 и CENR между собой.
- Категория: Система RH
В 1967 г. появилось сообщение Schmidt и соавт. [598], а вскоре и других авторов [151, 153, 338, 353, 404, 501, 638] о том, что эритроциты Rhnull имеют не только серологические, но и морфологические, а также функциональные нарушения.
^Клинические проявления в виде умеренной компенсированной анемии с характерными лабораторными показателями у лиц Rhnull, Rhmod, -D- и других фенотипов делеций получили название синдрома дефицита Rh-антигенов, или синдрома Rhnull.
При синдроме Rhnull эритроциты не двояковогнуты, как в норме, а имеют чашкообразную форму [638]. При этом наблюдают ретикулоцитоз [371, 492, 599] и повышенный уровень антигена i [599], свойственный эритроцитам новорожденных, что свидетельствует о выбросе в кровяное русло незрелых эритроцитов.
Синдром дефицита Rh-антигенов сопровождается также снижением концентрации гемоглобина, сывороточного гаптоглобина и гематокрита, увеличением концентрации сывороточного билирубина и фетального гемоглобина.
Осмотическая резистентность эритроцитов в пределах нормы или несколько снижена. Лизис эритроцитов Rhnu|1 in vitro предотвращается добавлением к
Трг-системе глюкозы. Электрофоретическая подвижность эритроцитов Rhnull не изменена [601].
Степень анемии широко варьирует у разных людей с дефицитом Rh, даже среди сибсов, унаследовавших одни и те же гены [492].
Продолжительность жизни эритроцитов Rhnull in vivo сокращена [598]. Время приживления эритроцитов Rhnull у лиц Rhnull составляло 14-36 дней [532], у лиц с обычным Rh-фенотипом - 48-56 дней [338], что существенно ниже нормы.
Тип наследования, регуляторный или аморфный, не сказывается на особенностях клинических проявлений. Синдром в равной степени наблюдают у лиц XX XQ и Щ [151, 1533, 338, 353, 411, 504, 601, 638], у некоторых из них клинические нарушения достигают средней тяжести [226].
Чаще всего дефицит Rh-антигенов ничем себя не проявляет, и его носители чувствуют себя здоровыми людьми. Issitt и Anstee [374] наблюдали мужчину Rhnull; его жена имела фенотип cde; двое детей были CcDee, что указывало на регуляторный тип Rh у этого мужчины. У 3 сибсов и 4 сводных братьев этого человека фенотипы Rh не отличались от обычных.
Авторы подчеркивают, что пациенту было 76 лет, когда впервые обнаружили, что он не содержит антигенов резус. Тот факт, что фенотип RhnulI не диагностировали столь длительное время, подтверждает бессимптомное течение гемолитической анемии, обусловленной дефицитом Rh-антигенов.
Клинически выраженные формы гемолитической анемии, обусловленные дефицитом Rh-антигенов, полностью излечиваются спленэктомией, которая, необходима лишь в редких случаях [601].
У больных Rh и, подвергнутых спленэктомии, а также у лиц, спленэктоми-рованных в связи с травмой селезенки, продолжительность приживления эритроцитов Rhnull не отличалась от времени приживления обычных эритроцитов. Аномалии в мембране эритроцитов Rh u, Rhmod и других Rh-делеций сами по себе не сказываются на продолжительности циркуляции этих клеток в кровяном русле. Укороченный срок их жизни объясняется тем, что они распознаются и затем разрушаются клетками селезенки. В организме, лишенном селезенки, разрушение Rh-дефицитных эритроцитов не происходит.
- Категория: Система RH
Локализация генов Х°г и XQ
При исследовании нескольких семей установлено, что модифицирующие гены Х°г и Xе, обусловливающие фенотипы Rhnull и Rhmod, не связаны с локусом RH [225,226, 244]. Далее была установлена локализация генов Х°г и X?.
Эксперименты Ridgwell и соавт. [565] с гибридизацией соматических клеток показали, что гены RHAG, кодирующие продукцию Rh-ассоциированного гликопротеина, расположены на хромосоме 6 и не связаны с генами RH, которые находятся на хромосоме 1. Однако Rh-полипептиды и Rh-гликопротеины представляют собой Rh-антигенную субстанцию только в совокупности. При отсутствии гликопротеинов, связанных с Rh-полипептидами, антигены Rh не экс-прессированы, как, например, при регуляторном (Х°г/Х°г) типе Rhnuir
Генетическая независимость локусов RHAG (Rh50) и RH, а также влияние первого на функцию второго позволили Cherif-Zahar и соавт. [213] высказать предположение: не являются ли гены Х°г и Xе мутантными формами гена Rh50, расположенного на хромосоме 6?
Примечание. Мутантные формы гена Rh50 обозначены символом Rh с цифрой 50, которая показывает мол. массу кодируемого Rh-гликопротеина. В данном случае Rh50 не следует отождествлять с Rh50, обозначающим антиген FPTT.
Указанные авторы [213] обследовали 5 человек RhnullH одного Rhmod. Из 5 Rh 4 были Х°г/Х% 5-й был r=/r=. Rh , имел тип Х^/Х^. У 4 Rh „и null mod null 1 Rhmod, имевших регуляторный тип X°r/X°r и XQ/XQ соответственно, обнаружены мутантные формы Rh50, включавшие различные нуклеотидные замещения. Только у человека r-/r= (Rhnull аморфного типа) транскрипт гена Rh50 был нормальным. При исследовании кДНК Rh50 в экспериментах с гибридизацией in situ было показано, что ген Rh50 расположен на хромосоме 6 в области pll-p21.1 [213].
Таким образом, имеются все основания полагать, что регуляторные по происхождению фенотипы Rh u и Rhmod обусловлены мутациями в локусе RHAG (Rh-ассоциированного гликопротеина).
- Категория: Система RH
Антитела, образующиеся у лиц RhnuU
Из 22 носителей Rhnull (пробандов и их родственников) 7 (30,2 %) содержали антиэритроцитарные антитела (см. табл. 4.24), что свидетельствует о весьма высокой частоте аллоиммунизации лиц, лишенных антигенов резус. Антитела имели аллоиммунный характер (беременности, трансфузии), за исключением одного случая спонтанных антител у мужчины - донора крови.
У 1 пробанда имелись антитела анти-С и анти-е, у 2 антитела были слабыми и не идентифицировались.
Важная деталь: 4 из 7 сывороток (пробанды 4, 8, 10 и 1 из 2 сестер 9-го) содержали антитела, реагирующие с эритроцитами всех фенотипов Rh, в том числе -D-/-D-: и других Rh-делеций, за исключением эритроцитов Rhnull. Эти антитела, подробно изученные Haber и соавт. [331] и Bar-Shany и соавт. [153], получили название anti-total-Rh, а выявляемый ими широко распространенный антиген был обозначен как Rh total (Rh29).
У родильниц Rhnull отмечены случаи умеренной и тяжелой ГБН, вызванной aHTH-Rh29-annn^aMH. Тяжелый случай успешно купирован обменными трансфузиями крови cde в течение первых 24 ч после рождения ребенка (Lubenko и соавт. [451]). В одном случае ГБН была связана с анти-Hr -антителами (Perez-Perez и соавт. [Am. J. Hematol., 1992, V. 40, P. 306]). °
По-видимому, иммунный ответ у лиц RhnuI1 ограничивается образованием ан-дател в; общим антигенам - Rh29 и Нго. Антитела к частным антигенам (С, е и др.) вырабатываются реже. ion иммунизации добровольцев эритроцитами Rhnull антител к веществу Rhnull получить не удалось. Известна лишь одно сообщение, свидетельствующее о возможности существования таких антител. McGinnis и соавт. [471, 472] нашли у 4 больных анемией антитела IgM и IgG, которые они назвали антипрекурсорными. Сыворотки реагировали только с эритроцитами RhnuI1. Со стандартными эритроцитами (не Rhnull) агглютинации не наблюдали, однако после обработки стандартных эритроцитов трипсином реакция все же происходила.
Повреждение других антигенов на эритроцитах Rhnull
В табл. 4.25 суммированы имеющиеся в литературе данные относительно изменения статуса некоторых групповых антигенов эритроцитов у людей с фенотипом Rhnull. В основном это касается антигенов S, s, U, LW, Fy и i.
Экспрессия антигенов S, s и, особенно, U на эритроцитах Rhnull существенно снижена. Как показали Schmidt и соавт. [598], почти половина сывороток анти-S, анти-s и анти-U не реагировали с эритроцитами Rhnull S, Rhnull s и RhnullU в антиглобулиновой пробе. В реакции солевой агглютинации эти образцы эритроцитов реагировали хорошо.
Таблица 4.25
Изменение экспрессии некоторых антигенов на эритроцитах Rhnu|
|
Фенотип |
Экспрессия антигенов |
|||||||
|
S |
S |
и |
LW |
Fy5 |
i |
Rh29 total |
D |
|
|
Rh 1 null |
1 |
1 |
| |
1 |
||||
|
Rh А mod |
н |
н |
н |
н |
н |
н |
н |
следы |
Примечание. { - экспрессия снижена, | - повышена, н - не изменена.
Race и Sanger [544] пришли к выводу, что связывание антител с указанными антигенами при фенотипе Rhnull слабее, чем в норме. Слабофиксированные антитела легко удаляются с поверхности эритроцитов в процессе их отмывания при постановке антиглобулиновой пробы. Этим и объясняются разные результаты, получаемые в антиглобулиновой пробе и реакции солевой агглютинации.
Антигены LWa, LWb, LWab и Fy5 в эритроцитах Rhnul] отсутствуют, так же как и антигены Rh-Hr. Гены LWn Fy расположены на хромосоме 1 рядом с локусом RH и, по-видимому, претерпевают те же изменения, что и гены резус. Отсутствие указанных антигенов наблюдали независимо от регуляторного (Х°г/Х°г) или аморфного (г=/г=) типа Rhnull.
Schmidt и соавт. [598] отметили повышенную экспрессию антигена i у жен-Шины Rhnull, больной анемией. Sturgeon [638] констатировал некоторое повышение экспрессии антигенов М и N при фенотипе RhnulI.
|j|Race и Sanger [544] исследовали эритроциты 5 лиц Rhnull двумя сериями сывороток анти-Епа и установили, что эритроциты Rhnull Еп(а+) реагируют значительно
Сййьнее, чем эритроциты Еп(а+) обычных людей. Указанные авторы отметили также повышение экспрессии антигенов Kidd и Dombrock на клетках Rhn |
Природа дефицита некоторых антигенов на эритроцитах Rhn | понемногу проясняется. Установлено (Dahr и соавт. [241]), что эритроциты Rh н обоих генетических типов содержат 30-40 % гликофорина В (структура, которая несет на себе детерминанты S, s и U), т. е. в 2-3 раза меньше, чем эритроциты U+ с нормальным фенотипом Rh. Дефицит антигенов LW на эритроцитах Rhnull обусловлен отсутствием в их мембране соответствующего LW-гликопротеина (Bloy и соавт. [173]).
В отличие от фенотипа Rh $ при котором все антигены Rh отсутствуют, фенотип Rhmod (модифицированный) содержит небольшое, иногда исчезающее количество Rh-антигенов. Некоторые образцы эритроцитов, идентифицированные вначале как Rhnи, при более детальном исследовании оказывались Rhmod. Как показали Stevenson и соавт. [629], Rhnull - не всегда нуль.
Фенотип Rhmod появляется в результате воздействия на локус RH регулятор-ного (супрессорного) гена Xs. Этот ген, как полагают Chown и соавт. [225, 226], является аллелем геи&Х°г или самостоятельным геном, расположенным в ином, чем Х°г, локусе, регулирующем количество Rh-субстанции.
Семейные исследования подтвердили, что лица с фенотипом Rh, имеют нормальные гены RH [225, 226]. Таким образом, генетическая основа Rh ^ всегда регуляторного типа, в отличие от Rhnull, который может быть обусловлен аморфным типом наследования.
Количество антигенов Rh на эритроцитах лиц Rhmod значительно варьирует. В одних случаях Rh-антигены выявляют прямой реакцией агглютинации, в других -только с помощью высокочувствительного метода адсорбции - элюции. Mallory и соавт. [Vox. Sang., 1976, V. 30, R 430] нашли, что исследованные ими образцы эритроцитов Rhmod содержат только 1,2 % ожидаемого количества D-антигена.
Содержание гликофорина В на эритроцитах Rhmod уменьшено до 70 % от нормы.
- Категория: Система RH
Различают 2 типа Rh ull: регуляторный (супрессорный) и аморфный (отсутствие генетического материала).
Регуляторный тип формируется в результате взаимодействия генов RH, производящих соответствующие полипептиды, и генов Х]г, Х°г, которые управляют функцией локуса RH. Ген Х1г (доминантный) запускает нормальную продукцию Rh-полипептидов, а его редкий аллель Х°г (рецессивный) блокирует их синтез.
Ген Х]г широко распространен, поэтому большинство людей являются гомозиготами - Xlr/Xlr. При таком генотипе унаследованные от родителей гены RH функционируют нормально. При гетерозиготном варианте (Xlr/X°r) экспрессия антигенов, по данным одних авторов, не нарушена [331, 532], по данным других - снижена [353].
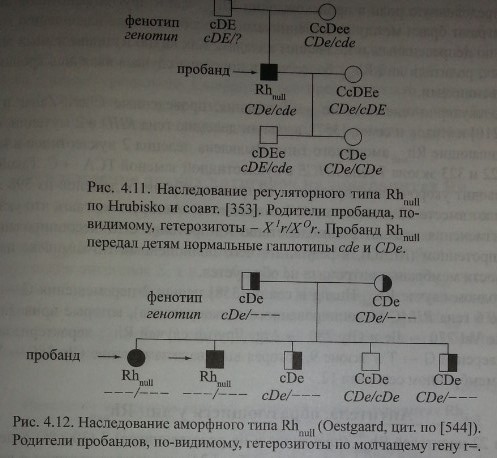
У людей, гомозиготных по супрессорному гену, Х°г/Х°г, присутствующие ДЯ-гены не функционируют. На рис. 4.11 представлен пример наследования ре-гуляторного типа Rh 1Г.
Аморфный тип Rhnull обусловлен отсутствием генетического материала, кодирующего продукцию Rh-полипептидов, по-видимому, вследствие делеции.
Получены данные, которые можно трактовать в пользу существования молчащего гена щ [371]. Пример наследования аморфного типа Rhnull представлен на рисунке 4.12. Родители пробандов - сибсы. Их фенотипы cDe и CDe создают видимость гомозиготности по генам с и С.
Судя по фенотипу детей, оба родителя были гетерозиготами: один, вероятно, cDe/r~> второй i CDe/r^. Двое детей имели одинаковый генотип г=/г=. Трое
других детей имели генотипы cDe/r=, CDe/r= и CDe/cDe. В приведенном примере недостает представителей третьего поколения, фенотипы которых могли бы подтвердить, что от родителей с аморфным типом Rhnul возможно рождение детей с таким же аморфным типом.
Обследование малого числа поколений в семьях не позволяет идентифицировать аморфный тип Rhnull, поскольку трудно получить убедительные доказательства того, что конкретный обследуемый человек генетически r=/r=, а не Х°г/Х°г. Генотип Х'г/Х°г также может приводить к уменьшению экспрессии антигенов Rh. Однако совокупность фактов, полученных при обследовании большого количества семей, позволила исследователям сделать вывод, что наследование Rhnull через молчащий ген г= вполне возможно.
Из 14 обладателей фенотипа Rhnull (см. табл. 4.24) у 9 был обнаружен регуля-торный тип Rhnull, у 3 - аморфный, у 2 - тип Rhnull не установлен.
Среди упомянутых выше 33 обследованных лиц Rh „ 20 имели регулятор-ный тип, 3 - аморфный тип, у остальных 10 человек генетическую основу нулевого фенотипа установить не удалось. Последующие многочисленные исследования подтвердили, что оба типа, регуляторный и аморфный, встречаются крайне редко, причем один из них, регуляторный, преобладает [151, 153, 331, 353, 532]. В некоторых случаях семейные исследования не могли выявить генетическую основу фенотипа Rhnull [501,647].
Определенную роль в происхождении Rhnull, как и других фенотипов делеций, играют браки между родственниками, способствующие накоплению гомозигот по депрессивным и молчащим аллелям. Как видно из приведенных выше данных, родители лиц Rhnullболее чем в половине случаев являлись кровными родственниками.
Молекулярно-генетические исследования, проведенные Cherif-Zahar и соавт. [210] и Huang и соавт. [357], выявили делецию гена RHD и 2 мутации, обусловливающие Rhnull аморфного типа. Выявлена делеция 2 нуклеотидов в кодо-нах 322 и 323 экзона 7 гена RHCE с нуклеотидной заменой ТСА Щ С. Такой ген производит укороченный протеин - 10 трансмембранных доменов из 398 аминокислот вместо 12 доменов из 417 аминокислот. Авторы полагают, что указанные изменения мешают взаимодействию Rh-протеина с Rh-ассоциированным гликопротеином (RhAG), в результате чего полноценный Rh-комплекс на поверхности мембраны эритроцита не образуется.
В одном случае Rhnull Huang и соавт. [358] нашли 2 перемещения G —> А в экзоне 6 гена RHAG (ассоциированного гликопротеина), которые приводили к замене Val 270 —| Не и Gly 280 й Arg. Другой случай Rhnull характеризовался трансверсией G —» Т в экзоне 9, которая вызывала замещение Gly 380 —> Val в трансмембранном сегменте 12.
- Категория: Система RH
Встречаются люди, эритроциты которых не содержат одного, нескольких или всех антигенов Rh или содержат их в редуцированном количестве. До 1980-х годов, когда методы молекулярно-генетического анализа еще не были доступны как сегодня, отсутствие антигенов объясняли выпадением (делецией) соответствующего генетического материала и относили к группе аномалий, получивших название «фенотипы делеции».
Термин не совсем точный, поскольку молекулярные исследования последующих лет показали, что генетический материал у таких людей нередко присутствует, однако не продуцирует Rh-полипептиды.
Отсутствие или слабую выраженность антигенов Rh объясняли также особенностями функционирования гибридных генов, в которых часть экзонов гена D заменена экзонами гена СЕ, и наоборот.
Тем не менее понятие «фенотипы (гаплотипы) делеции» удобно, поскольку объединяет в себе все формы выпадения или редукции Rh-антигенов, которые, несмотря на разное происхождение, имеют одинаковое фенотипиче-ское проявление, то есть не выявляются или слабо выявляются серологическими методами.
Известны следующие фенотипы делеции: -D- [551], D** [236, 243], DCW- [327], Dc- или Dc(e) [649], DIV(C)- [593], Rhnull [346, 347, 689]. Скобками выделяют слабовыявляемые антигены: (е), (С) и т. д. Знак минус означает отсутствие в эритроцитах только антигенов С, с, Е и е, но не других Rh-антигенов как часто встречающихся - Rh total (Rh29), HrB (Bastiaan, Rh34), Rh39, выявляемых аутоантителами, Nou (Rh44), Sec (Rh46), Dav (Rh47), MAR (Rh51), так и редко встречающихся - Cw, Goa, Evans, Таг и др. (табл. 4.22), которые могут присутствовать в этих эритроцитах.
Описано более 70 семей, члены которых были гомо- и гетерозиготными по упомянутым делениям [374, 544]. Чаще такие фенотипы встречались в семьях, где родители были близкими родственниками. Race, Sanger [544] собрали сведения о 23 лицах -D-/-D-, у 20 из них родители состояли в родстве.
Выпадение антигенов обнаруживали при выяснении причин ПТО и ГБН. Лица с фенотипом делеции легко вырабатывают резус-антитела к недостающим у них Rh-антигенам, что и служило причиной осложнений.
Антитела у лиц с Rh-делениями отличаются от резус-антител, обнаруживаемых у резус-отрицательных людей, своей необычностью. Именно в сыворотках этих людей найдены антитела анти-Нго, анти-Hr, анти-Нгв, анти-Nou, анти-Dav и другие, позволившие открыть одноименные антигены. Обычные люди (без Rh-делеций), как правило, содержат все перечисленные часто встречающиеся антигены и не могут вырабатывать к ним антитела.
Многие образцы эритроцитов, относящиеся к фенотипам делеции, за исключением Rhnull, содержат антигены D, G, Rh total и Rh39.
Первый из выявленных фенотипов делеции (-D-) обнаружили Race, Sanger и Selwyn в 1951 г. Затем были описаны другие случаи гомо- и гетерозигот -D-[149, 229, 480, 502, 556, 592, 725]. Последний случай опубликован в 1991 г. Moores и соавт. (Humen Hered., 1991, V. 41, R 295).
Эритроциты -D- не содержат антигенов С, с, Е и е. При этом антигены D, G, Rh total и Rh39 сильно выражены; часто встречающиеся антигены: Hro, Nou, Dav и др. - отсутствуют.
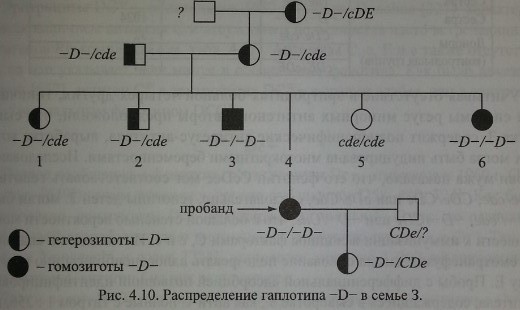
В России фенотип -D- обнаружен в 1985 г. В.А. Мороковым [82] и подробно исследован Т.М. Пискуновой с соавт. [87]. Описанный случай представляет собой классический пример фенотипа -D-.
Наблюдение. Беременная 3., 35 лет, В(Ш) Rh+, диагноз - неразвивающаяся беременность 24 недели. В анамнезе 1 гемотрансфузия и 6 беременностей, из которых первые 2 закончились рождением здоровых детей, 3-я и 4-я - искусственным прерыванием, 5-я - внутриутробной гибелью плода, 6-я беременность, неразвивающаяся, послужила показанием к экстирпации матки. Эритроциты 3. содержали антиген D, но не содержали антигенов С, с, Е, е и Cw.
Бабушка, отец и мать 3. имели гаплотип -D- в гетерозиготном варианте. Всего в семье обнаружено 3 гомозиготы и 6 гетерозигот
Эритроциты гетеро- и гомозигот -D- проявляли необычайно высокие агшютина-бельные свойства. Титр сывороток анти-D при титровании этими эритроцитами соответствовал 1:256-1:1024, в то время как с эритроцитами доноров контрольной группы титр антител не превышал 1:64 (табл. 4.23). Наиболее выраженная агглютинабельность эритроцитов отмечена у гомозигот -D-/-D-. Результаты этих экспериментов совпадают с данными других авторов, свидетельствующими о том, что эритроциты -D- содержат повышенное количество D-несущих полипептидов (см. Экспрессия антигена D).
Сыворотка 3. реагировала со всеми образцами стандартных эритроцитов независимо от сочетания Rh-антигенов, поэтому подобрать ей совместимую кровь среди доноров оказалось невозможным. С собственными эритроцитами и эритроцитами одного из братьев и одной из сестер сыворотка 3. не реагировала.
В методе солевой агглютинации положительный результат наблюдали только с эритроцитами, содержащими антиген С, что указывало на присутствие в сыворотке полных анти-С-антител.
|
Член семьи |
Генотип |
Титр анти-О-антител с эритроцитами членов семьи и доноров контрольной группы |
|
|
Бабушка |
-D-/cDE |
1 |
: 512 |
|
Мать |
-D-/cde |
1 |
: 512 |
|
Сестра |
-D-/cde |
1 |
:256 |
|
Брат |
-D-/cde |
1 |
256 |
|
Брат |
-D-/-D- |
1 |
1024 |
|
Пробанд |
-D-/-D- |
1 |
1024 |
|
Сестра |
cde/cde |
||
|
Сестра |
-D-/-D- |
1 |
1024 |
|
Доноры (контрольная группа) |
CDe/cde |
1: |
32 |
|
CDe/CDe |
1: |
32 |
|
|
cDE/cDE |
1: |
64 |
|
Учитывая отсутствие в эритроцитах больной четырех других, типичных для системы резус минорных антигенов, авторы предположили, что сыворотка 3. содержит полиспецифические антирезус-антитела, выработка которых могла быть индуцирована многократными беременностями. Исследование крови мужа показало, что его фенотип CcDee мог соответствовать генотипу CDe/cde, CDe/CDe или cDe/Cde, следовательно, генотипы детей 3. могли быть -D-/cde, -D-/CDe или -D-/Cde, что с большой степенью вероятности могло привести к иммунизации женщины факторами С, с и е. Имеющаяся в анамнезе 3. гемотрансфузия давала основание подозревать аллосенсибилизацию к антигену Е. Пробы с дифференциальной адсорбцией позволили идентифицировать антитела, содержащиеся в сыворотке 3., как анти-С полные с титром 1 : 256, неполные анти-с с титром 1 : 2048 и неполные анти-е с титром 1 : 128.
Резюмируя описанное В.А. Мороковым наблюдение, уместно подчеркнуть, что антитела к минорным антигенам С, с и е встречаются относительно редко и имеют низкий титр. На этом фоне способность продуцировать антитела одновременно к обоим антитетичным антигенам - С и с - и к антигену е (hr") в столь высоком титре подчеркивает особый иммунологический статус гомозигот —D -/-/)-, характеризующийся повышенной чувствительностью к недостающим факторам Rh, которые являются для них сильным иммуногеном.
Эритроциты *D* обнаружены Contreras и соавт. [237]. Они содержат повышенное количество антигена Бив серологических реакциях проявляют себя подобно эритроцитам -D-, однако в отличие от последних содержат антигены Evans (Rh37) и Dav (Rh47). Особенности фенотипа *D*, отличающие его от других фенотипов делеций, представлены в табл. 4.22.
Фенотип *D*, как и другие фенотипы Rh-делеций, не содержит общих, широко распространенных Rh-антигенов, присущих нормальному Rh-комплексу (Hro, HrB, Sec и MAR), а также большинства редких Rh-антигенов (Go8, Tar, FPTT и др.).
ИрМиссис Helen Dav, у которой были найдены эритроциты *D*, имела антитела, реагирующие с некоторыми образцами эритроцитов от лиц с Rh-делециями, а ее эритроциты реагировали с некоторыми сыворотками от указанных лиц. Анализ особенностей реагирования эритроцитов миссис Dav привел к открытию одноименного антигена (см. Dav).
DCW-
Эритроциты DCW-, описанные в 1957 г. Gunson, Donohue [327], характеризуются наличием антигена G и отсутствием большинства часто встречающихся антигенов Rh-комплекса (см. табл. 4.22). Антигены С, с, Е и е также отсутствуют, на что указывает знак минус в обозначении фенотипа. Как было показано Tippett [657], антиген Cw в эритроцитах DCW- выражен слабее, чем в эритроцитах с нормальным фенотипом DCCwe.
Dc-
Первое сообщение о фенотипе, обозначенном Dc-, относится к 1960 г. (Tate и соавт. [649]), затем появились другие публикации [258, 440, 724]. Как было установлено, эритроциты Dc- не содержат антигенов С, Е и е, но отличаются большой вариабельностью в отношении количества антигена с (hr'). Так, по данным Yamaguchi и соавт. [724], экспрессия антигена с (hr') на эритроцитах Dc- снижена, антиген f на них отсутствует.
Tate и соавт. [649] нашли, что, несмотря на ослабленный антиген с (hr') и отсутствие антигена е (hr"), эритроциты Dc- содержат антиген f, но в ослабленной форме. Отдельные образцы эритроцитов Dc- содержали некоторое количество антигена е (hr"). Такой фенотип более соответствовал написанию Dc(e), т. е. Dc со слабым е (hr"), или Dc((e)), т. е. Dc с исчезающим количеством е (hr").
Leyshon и соавт. [440] привели данные о нормальной выраженности антигена с (hr') и f (се) на эритроцитах Dc-. Однако Spielman и соавт. [Vox Sang., 1974, V. 27, R 473] описали случай ГБН, вызванный aHTH-f-антителами, у женщины, которая имела генотип CDe/Dc-, что вступает в противоречие с данными Leyshon и соавт.
Многие авторы сходятся во мнении, что количество антигена D в эритроцитах Dc- выше, чем в обычных эритроцитах D+.
Tessel и соавт. [650] описали фенотип Dc- негра и негритянки, не связанных родством. Эритроциты мистера J.W. содержали повышенное количество антигена D, уменьшенную по сравнению с нормой дозу антигенов с (hr1) и f, а также слабый антиген е (hr"). Эритроциты миссис F.J. «держали повышенное количество антигена D, уменьшенную дозу антигена с (hr'), но не содержали антигенов f и е (hr"). Эритроциты мистера J.W. реагировали с антителами анти-Нго/Нг, имевшимися в сыворотке крови миссис F.J. и двух гомозигот -D-/-D-, а также с двумя из трех сывороток анти-nl. Эритроциты миссис F.J. не реагировали с сыворотками анти-Нго/Нг и анти-nl. Авторы пришли к выводу, что ген Dc- гетерогенен и может кодировать 2 фенотипа Dc-, один из которых содержит антиген f, трудновы-являемый антиген е, антигены Нгои Нг, а другой фенотип Dc- не содержит перечисленных антигенов.
DIV(C)-
В 1969 г. группой исследователей [593], включая классиков современной им-муносерологии Sanger, Tippett и Salmon, был описан единственный известный до настоящего времени человек с генотипом DIV(C)-/DIV(C)-. Людей, гетерозиготных по гаплотипу DIV(Q- обнаружено несколько. Гаплотип DIV(C)- производит парциальный антиген D категории IVa, антиген G и значительно уменьшенное количество антигена С.
В гомо- и гетерозиготном варианте генный комплекс DIV(C)- обеспечивает экспрессию редко встречающихся антигенов: Goa(Rh30) [593], RoHar(Rh33), Riv (Rh45) и FPTT (Rh50) [257], а также часто встречающихся Rh-антигенов: Rh total (Rh29), Rh ауто-С-подобный (Rh39), Dav (Rh47) и Nou (Rh44), которые не кодируются другими гаплотипами Rh-делеций (см. табл. 4.22).
Антиген Nou был впервые обнаружен на эритроцитах гомо- и гетерозигот DIV(C)-(cu.Nou).
Хотя эритроциты DIV(C)- лишены антигена е (hr"), 3 из 10 сывороток анти-е давали реакции с этими эритроцитами, что указывает на продукцию некоторого количества антигена е (hr") или Се (rh}) гаплотипом DIV(C) —.
Rhnilll
Среди упомянутых выше фенотипов делеций (-D-, Dc-, DIV(C)~ и DCW-), при которых наблюдается выпадение 2 антигенов и более, фенотип Rhnu|| занимает особое место. Он отличается отсутствием всех антигенов системы Rh-Hr, а также антигенов системы LW и Duffy, кодируемых генами, близко расположенными к локусу RH.
О первой находке необычного генотипау аборигенки Австралии сообщили в 1961 г. Vos и соавт. [689]. В 1964 г. такой же генотип описали Levine и соавт. [428] у белой американки. Двумя годами позже, в 1966 г., Ishimori, Hasekura [371] нашли нулевой Rh-фенотип у японского мальчика.
По данным Race и Sanger [544], к 1975 г. было описано более 20 лиц Rhnull из 14 семей, отличавшихся расовой принадлежностью (табл. 4.24). К этой сводке можно добавить 11 случаев Rhnull, приведенных Daniels [244].
Issitt и Anstee [374] насчитали 33 случая Rhnull, 1 из которых обнаружен ими.
Фенотип Rhn „ у лиц, внесенных в табл. 4.24, диагностирован при различных обстоятельствах. В 1-м случае он был обнаружен при проведении популяцион-ных исследований у австралийских аборигенов. В других случаях (2, 4, 6, 8, 10, 11 и 12-м) - при выяснении специфичности антител, в том числе у больных тяжелой формой гемолитической анемии (8, 11 и 12-м), а также при обследовании доноров, рожениц, новорожденных (3,5,7,9,13 и 14-м).
Родственники носителей Rhnulib некоторых случаях также имели нулевой фенотип или сниженную экспрессию Rh-антигенов. По сводке Daniels [244], из 11 лиц, имевших дефицит Rh-антигенов, 8 были детьми от близкородственных браков. Из общего числа обследованных 6 человек японцы.
Относительно большое число лиц Rhnull среди японцев обусловлено, скорее всего, не тем, что в этой популяции высокая частота указанного фенотипа, а проведением широких популяционно-скрининговых исследований, в процессе которых возможно выявить людей со столь редким фенотипом.
Обозначение--------- /--------- , использованное Vos и Levine с соавторами [428,689], было признано неточным, поскольку означает отсутствие генетического материала у носителей этого фенотипа. В действительности гены RH у таких людей часто присутствуют, но не проявляют себя фенотипически. По предложению Ceppellini фенотип с отсутствием Rh-антигенов получил название Rhnull. Обозначение-------- /-------- сохранилось для описания гена г=, который, как позднее выяснилось, представляет собой молчащий (не производящий продукта) аллель локуса RH.
Новости медицины
Много миллионов человек в мире принимают статины, но исследования показывают, что только 55% из тех, кому рекомендуется принимать статины, принимают их. Это большая проблема, потому что исследования также показывают, что те из группы...
Связанное с беременностью высокое кровяное давление может привести к долгосрочным сердечным рискам, показывают новые исследования.
Кэролин Консия, столкнулась с более серьезными последствиями репрессий против назначения опиоидов, когда узнала, почему сын ее подруги покончил с собой в 2017 году.
Новое исследование показывает, что психические заболевания не являются фактором большинства массовых расстрелов или других видов массовых убийств.