Как уже указывалось выше, серологически определяемые антигены А, В и Н не являются непосредственными продуктами генов. Гены А, В и //контролируют синтез соответствующих трансфераз. В настоящее время строение генов АВО и Я расшифровано (рис. 3.7). Их удалось клонировать и секвенировать. Расшифрована также аминокислотная последовательность А- и В-трансфераз, которые отличаются друг от друга двумя аминокислотами в позициях 266 и 268 (рис. 3.8).
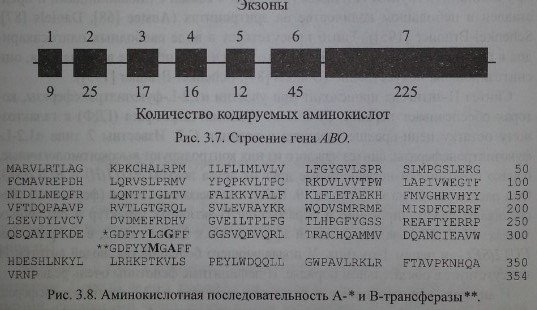
Гены АВО содержат по 1062 пары оснований и кодируют пептиды, состоящие из 354 аминокислот (Reid, Lomas-Francis [186]). Секвенирование генов А и В позволило установить отличающие их последовательности в 7 кодонах, 4 из них (в позициях 176, 235, 266 и 268) могут быть причиной замены аминокислот в трансферазах. Секвенирование гена 01 показало его идентичность с А1 до нуклеотида 261, с которого рамка считывания нарушается с образованием стоп-кодона (Daniels [87]). Такой аллель кодирует синтез пептида, не обладающего какой-либо трансферазной активностью.
Выявлено несколько вставок: гуанин-цитозин (GC boxes), которые находятся выше кодона, инициирующего транскрипцию, и могут играть важную роль в регуляции активности трансфераз. Транскрипция генетической информации зависит от мини-сателлитов - участков размером 4 кб, расположенных выше начального участка считывания. Эксперименты с трансфекцией генов показали, что активность транскрипции гена А по сравнению с В существенно ниже.
Найдены часто встречающиеся аллели, характерные для представителей различных этнических групп. Так, примерно 80 % аллелей А1 среди японцев отличались от аллелей А1 европейцев мутацией, ведущей к замене проли- на на лейцин в положении 156. Однако это никак не проявляло себя на фенотипическом уровне (Olsson и соавт. [176-178]). Вместе с тем вставка одного нуклеотида в позиции от 798 до 804 в аллеле А2 приводила к синтезу продукта, не обладающего трансферазной активностью (аллель О3) (Olsson и соавт. [179]). При сравнении нескольких аллелей установлена их гибридная природа. Образование гибридов, включающих фрагменты двух разных аллелей, авторы объясняют кроссинговером во время мейоза. В большинстве случаев кроссин- говер затрагивал экзон 6. При наличии делеции G 261 экзон 7 фенотипически не проявлялся. В тех случаях, когда экзон 6 не содержал указанной делеции, экзон 7 аллеля А1 или О1 проявлял себя фенотипически как Aj-серологическая активность. Экзон 7 аллеля О/v проявлял себя как А2-серологическая активность (Ogasawara [170]).
Описана семья, в которой мать имела группу В, ребенок - А, отец - О. На первый взгляд, такие результаты серологического исследования в традиционной интерпретации должны были исключить отцовство. Однако результаты молекулярно-генетического исследования не позволили этого сделать. Секвенирование генов АВО членов данной семьи показало, что у ребенка имелся гибридный ген, экзон 6 которого содержал фрагменты гена В, а экзон 7 - фрагменты гена 0lv. Поскольку экзоны 7 аллелей А1 и 01у идентичны, а в экзоне 6 указанного гибридного гена, B-0Iv, отсутствовала делеция G 261 (стоп-кодон), на эритроцитах ребенка сформировался антиген A (Olsson и соавт. [177]). Вероятно, этот 2?-0Уу-гибридный ген с А-трансферазной активностью возник во время мейоза в результате кроссинговера.
В литературе появляется все больше материалов, свидетельствующих о гетерогенности аллелей А, В, Н и Se среди представителей различных рас и этнических групп. Молекулярно-генетические методы позволяют выявлять варианты генов с точковыми мутациями, делециями, гибридными включениями (табл. 3.14, 3.15, 3.16, рис. 3.8), приводящими к формированию стоп-кодонов, инактивации участков сплайсинга (Ogasawara и соавт. [170]). В ряде случаев отмечены эпистатические эффекты в виде аллельного угнетения (Feng и соавт. [101]) или, напротив, аллельного усиления активности генов (Morel и соавт. [162], Ogasawara и соавт. [171]). Структурные особенности генов часто не проявляют себя и лишь в редких случаях приводят к появлению необычных
Таблица 3.1 б
Аллели, ассоциированные со слабой экспрессией В
|
Фенотип |
Аллель |
Замена нуклеотидов |
Замена аминокислот |
|
вз |
В3-1 |
С 105 4T |
Arg 352 Tip |
|
В X |
Bw-1 *В104 |
G 871 А |
Asp 291 Asn |
|
Ве, |
Ве1-1*В105 |
Т 641 G |
Met 214 Arg |
|
Ве1 |
Ве1-2 *В10б |
G669T |
Glu 223 Asp |
|
В W |
Bw-2 |
С 873 G |
Asp 291 Glu |
|
В W |
Bw-3 |
С 721 Т |
Arg 241 Trp |
|
В W |
Bw-4 |
А 748 G |
Asp 183 Gly |
|
В W |
Bw-5 |
G 539 А |
Arg 180 His |
|
В W |
Bw-6 |
А 1036 G |
Lys 346 Glu |
|
в W |
Bw-7 |
G 1055 А |
Arg 352 Gin |
|
в W |
Bw-8 |
T863 G |
Met 288 Arg |
Высокая степень гомологии локуса АВО человека обнаружена также при сравнении с аналогичными локусами других млекопитающих: хомяков, крыс, мышей, овец, коров, кроликов, кошек и собак (Daniels [87], Roubinet и соавт. [190]). Интересная деталь: трансферазная активность локуса АВО у мышей вдвое выше, чем у человека (Roubinet и соавт. [190]).
Высокая степень подобия выявлена при секвенировании генов FUTl(Hh) и FUT2(Se) (табл. 3.17, см. рис. 3.8). Полагают, что локус FUT2 мог произойти в результате преобразования гена FUT1 (Daniels [87]).
Таблица 3.17
Аминокислотная последовательность гликозилтрансфераз у млекопитающих
Перспектива создания универсальных эритроцитов привлекла многих исследователей, появилась возможность конвертировать эритроциты группы А в О, и таким образом решить проблему АВО-несовместимых гемотрансфузий.В настоящее время предпринимаются попытки синтезировать а-галакгозилазу генно-инженерным путем, поскольку фермент из натурального сырья дорог окончательно не выяснен. Недостаточно изучены естественные эндогенные ингибиторы антителообразования, которые, по-видимому, могут влиять на состояние респондерства или нереспондерства в отношении резус-антигена.
|
Вид |
Аллель, антиген, энзим |
Высокогомологичный фрагмент аминокислотной последовательности |
|
|
Человек |
А101 |
FTYERRPQSQAYIPKDEGDFYYLGGFFGG |
272 |
|
Человек |
В101 |
FTYERRPQSQAYIPKDEGDFYYMGAFFGG |
272 |
|
Человек |
001 |
FTYERRPQSQAYIPKDEGDFYYLGRFFGG |
272 |
|
Человек |
цис-АВ |
FTYERRPQSQ AYIPKDEGDF YYLG AFF GG |
272 |
|
Мышь |
АВ |
FTYERRPQSQAYIPWDRGDFYYGGAFFGG |
251 |
|
Свинья |
А |
FTYERRPLSQAYIPRDEGDFYYAGGFFGG |
282 |
|
Собака |
Антиген Форссмана |
FP YERRHISTAF VAENEGDF Y Y GG AVF GG |
267 |
|
Мышь |
Г алактозилтрансфераза |
FT YERRELS AAYIPFGEGDF YYHAAIF GG |
312 |
|
Корова |
Г алактозилтрансфераза |
FTYERRKESAAYIPFGEGDFYYHAAIFGG |
286 |
|
Крыса |
ЮЬЗ |
LPYERDKRSAAALSLSEGDFYYMAAVFGG |
259 |
Не утверждая, что это лежит в основе статуса нереспондерства, мы тем не менее приведем некоторые размышления. Предположим, что резус-принадлежность D- данного человека обусловлена неполной делецией гена D, и небольшая часть генетического материала все же сохранилась. Этой части не достаточно, чтобы воспроизводимый ею субстрат мог быть выявлен серологически как D+, однако может быть достаточно, чтобы антиген D, введенный с перелитой кровью, не воспринимался как чужеродный. Таким образом, нереспондеры по отношению к резус- антигену - это лица, в эритроцитах которых присутствует вещество, гомологичное антигену D, в небольшом, серологически невыявляемом количестве (скрытый D). Не исключено, что такие лица могут иметь фенотип Del, при котором следовые количества антигена D выявляют только с помощью адсорбции - элюции.
Предпринятые некоторыми исследователями попытки индуцировать состояние толерантности к резус-фактору посредством орального введения эритроцитов Rh+ не увенчались успехом. Остается недоказанным предположение о существовании гена респондерства и нереспондерства.
Благодаря молекулярно-биологическим исследованиям Colyn, Mouro, Wolter, Cherif-Zahar, Le Van Kim и других исследователей стало понятно, почему антиген D столь иммуногенен.
В 1991 г. Colyn и соавт. [233] выяснили, что резус-положительные лица имеют 2 гена: RHD и RHCE, кодирующие выработку резус-антигенов. В то же время у большинства резус-отрицательных людей ген RHD подвергнут делеции и они имеют только 1 ген - RHCE. Последний представлен 4 аллелями: RHCe, RHcE, RHce и RHCE, кодирующими соответственно 4 варианта субстрата - Се, сЕ, се и СЕ. Полипептиды, кодируемые аллелями RHCE, имеют весьма значительное структурное сходство.
Как установили Mouro и соавт. [496], Wolter и соавт. [720], Cherif-Zahar и соавт. [208], Le Van Kim и соавт. [418], полипептид, несущий иммунодоминант- ный эпитоп С, отличается от полипептида, несущего иммунодоминантный эпитоп с, всего лишь четырьмя аминокислотами в цепи из 417 аминокислот, и лишь одно из этих 4 различий определяет специфичность С и с. Полипептид, несущий Е-специфичность, отличается от несущего е-специфичность одной аминокислотой. Иными словами, когда реципиенты Cde получают трансфузию эритроцитов cde, а реципиенты cde - трансфузию эритроцитов Cde, иммунная система реципиента не всегда отличает перелитое вещество Rh от своего собственного. То же самое происходит, когда людям с фенотипом cDE, cdE или cDe, cde переливают эритроциты cDe, cde или соответственно cDE, cdE: их иммунная система не в состоянии отличить чужой антиген от собственного по одной различающейся позиции.
Полипептид, кодируемый геном RHD, отличается от кодируемого геном RHce по величине [208, 233, 418, 496, 720]. Такое различие существенно для иммунной системы реципиента. При делеции гена RHD кодируемое им вещество Rh не производится, поэтому вводимый при гемотрансфузии антиген практически не имеет у реципиента какого-либо эквивалента. Иммунный ответ особенно сильно проявляется у лиц с фенотипом -D- и Rhnull, у которых часть или все антигены Rh отсутствуют. В этом случае антигенные различия реципиента и донора, даже если последний Rh-, очень велики.
На основании результатов молекулярно-биологических исследований, свидетельствующих о незначительных различиях в структуре минорных резус- антигенов С, с, Е, е, а также основываясь на данных статистики, показывающих, что частота антител к этим антигенам невысока, некоторые исследователи предлагают пересмотреть существующее положение о резуе-положительных и резус-отрицательных донорах. В частности, предлагается относить к резус- отрицательным донорам лиц D-, содержащих антигены С и Е, и узаконить трансфузии крови Cde, cdE и CdE резус-отрицательным реципиентам. По их мнению, такой подход, позволит расширить ресурсы донорской крови Rh-, сэкономит значительные средства, затрачиваемые на дополнительное типирова- ние доноров по факторам С и Е, и связанные с этим другие расходы.
Хотя мировое сообщество трансфузиологов в целом не приняло этот предложение, оно не лишено здравого смысла.
Придерживаясь общепринятого положения, предписывающего относить к резуе-отрицательным донорам только лиц, не содержащих факторов D, С и Е, мы все же рассмотрим его по существу.
В начале 50-х годов прошлого столетия сложилось представление о том, что для реципиентов cde антигены С и Е столь же иммуногенны, как D. Это представление базировалось на данных о высокой частоте встречаемости антител анти-С и анти-Е в виде комбинированных сочетаний: анти-DC и анти- DE. Создавалась видимость высокой иммуногенности этих факторов и отсюда опасение, что для реципиентов D-C-E- антигены С и Е будут также иммуногенны. В действительности чистые антитела к факторам С и Е без анти-D- антител встречаются редко, что свидетельствует об их невысоких иммуноген- ных свойствах.
Для того чтобы еще больше обезопасить резус-отрицательных реципиентов от возможной аллоиммунизации, им переливают эритроциты, не содержащие этих факторов. Предпочтение такой тактики было в значительной степени произвольным, поскольку объективная статистика, подтверждающая правомерность такого подхода, отсутствовала.
В то же время реципиентам Rh+ переливают эритроциты, которые в 20-30 % случаев не идентичны по антигенам С и Е, не опасаясь при этом вызвать аллоиммунизацию. Вряд ли такой подход можно признать правильным, поскольку реципиенты Rh+, хотя и редко, но все же иммунизируются минорными антигенами с, Cw, С, Е и е. В табл. 4.2 представлены данные, характеризующие степень иммуногенности минорных Rh-антигеновискусственная иммунизация нативными и энзимированными эритроцитами не позволяла получить эти антитела (Р.С. Сахаров [96, 98]).
В опытах по иммунизации, когда инъекции продолжались в течение полутора лет, Jones, Diamond и Allen (1954) не смогли стимулировать продукцию анти-С и анти-Е ни у одного из 32 человек D+.
Очень часто иммунизация, предпринятая с целью получения антител анти-С и анти-Е, приводит к выработке антител анти-KEL 1 или анти-hr' (с). Об этом свидетельствуют многочисленные данные, полученные отечественными исследователями Т.Г. Соловьевой, А.Г. Башлай, Р.С. Сахаровым, В.А. Мороковым, И.С. Липатовой и другими, занимавшимися направленной искусственной иммунизацией с целью получения моноспецифических тестовых сывороток.
Анти-С-антитела хотя и редки, но значительно чаще образуются у резус- отрицательных людей, чем у резус-положительных, что еще раз подтверждает правильность современной трансфузиологической тактики, предусматривающей переливание резус-отрицательным реципиентам эритроцитов, лишенных антигенов С и Е. Сложившуюся повсеместно практику переливания эритроцитов Rh+ резус-положительным реципиентам без учета факторов С и Е вряд ли можно считать идеальной, поскольку это приводит к аллоиммунизации реципиентов факторм hr' (с), который иммуногенен для гомозигот CDe/CDe и обусловливает около 3 % посттрансфузионных осложнений.
Итак, многие аргументы убеждают в необходимости переливать эритроциты, идентичные по основным антигенам системы Rh-Hr: D, С, Е, с, е. К этому перечню необходимо добавить антиген Cw, частота сенсибилизации к которому составляет 1-2 % [40].
Роль Rh-антигенов в биологии человека неясна. Gahmberg и соавт. [296], Ridgwell и соавт. [566], Paradis и соавт. [517] полагают, что резус-антигены являются лишь структурным элементом мембраны эритроцитов. Число молекул полипептида Rh и гликопротеина Rh на 1 эритроцит достигает 200 тыс. (Hughes- Jones и соавт. [364]), что делает их основными мембранными белками.
Вещество Rh присутствует только в эритроцитах и, по-видимому, выполняет определенную функцию, специфичную именно для этих клеток.
По данным Schmidt и соавт. [5] и Sturgeon [638], эритроциты людей с фенотипом Rhnull, при котором, как известно, отсутствуют Rh-антигены, имеют эллипсоидную форму. Концентрация анионов в мембране снижена (Balias и соавт. [151]). Эритроциты часто дегидратированы из-за повышенного транспорта воды через клеточную мембрану (Lauf, Joiner [411], Nash, Shojania [504]). Срок их приживления in vivo меньше, чем обычных эритроцитов [598].
Ridgwell и соавт. [565] нашли, что аминокислоты Glu 21 и Glu 146 в трансмембранной части Rh-полипептида и аминокислоты Glu 13 и Glu 148 в трансмембранной части Rh-гликопротеина обеспечивают движение катионов через мембрану эритроцита и относятся к структурам, которые подобно аквапорину-1 (антигену Colton) являются транспортерами воды в клетку.
Система резус полиморфна. Помимо четко очерченных антигенов, она включает варианты, при которых антигены выражены слабо либо вовсе не продуцируются. Для ясности дальнейшего изложения объясним некоторых обозначения, встречающиеся в современных публикациях.
Как видно из табл. 4.5, наименования отдельным вариантам, в том числе редко встречающимся, присваивали в значительной мере произвольно. В этом плане классификация ISBT внесла определенный порядок. Тем не менее обозначения, характеризующие необычную выраженность антигенов или их неожиданное отсутствие, в литературе сохраняются, например фенотипы Rhnull, -D-, (C)D(e). В последнем случае необычные фенотипы со слабовыраженны- ми антигенами Сие, кодируемые геном RN и чаще встречающиеся у негров, обозначают как (C)D(e), выделяя скобками очень слабые или практически отсутствующие антигены Сие.
Обозначение f (се) и rh. (Се) с дублирующим синонимом, помещенным в скобки, более информативно для читателя, чем обозначение этих антигенов как f и rhj, поскольку указывает на генетическую подоплеку их формирования (позицию цис генов се или Се). Антиген f продуцируется комбинацией генов с иев положении цис. При размещении генов спев позиции транс антиген f не формируется. Аналогичная ситуация имеет место в отношении антигена rh., который вырабатывается в том случае, если как минимум на одной из унаследованных гомологичных хромосом в позиции цис расположены локусы Си е. Гены С и ев позиции транс антигена rh. (Се) не производят.
Антигены резус встречаются с частотой: D - 85 %, С - 70 %, с - 80 %, Е - 30 %, е - 97,5 %. В табл. 4.6 представлены варианты фенотипов и генотипов Rh, а также результаты серологических реакций, в которые вступают эритроциты с тем или иным сочетанием антигенов резус. Фенотип Rh-Hr выявляют с помощью
5 сывороток: анти-D, анти-С, анти-Е, анти-с и анти-е. Сыворотки анти-се, анти- Се, анти-сЕ и анти-СЕ обнаруживают на эритроцитах дополнительный антигенный продукт, кодируемый генами, когда они находятся в одном гаплотипе одновременно. Реагирование этих сывороток при одинаковом фенотипе, но разном генотипе людей не совпадает, что может быть использовано для установления генотипа Rh по фенотипу. Например, лица с фенотипом CcDEe (Се+се-сЕ+СЕ-), с большой степенью вероятности (99,99 %) имеют генотип CDe/cDE (генотипы Cde/cDE или CDe/cdE менее вероятны), а лица с тем же фенотипом CcDEe (но Се-се+сЕ~СЕ+) имеют генотип CDE/cde или, что менее вероятно, CdE/cDe.
Выраженность антигенов Rh на эритроцитах варьирует в широком диапазоне. Выделяют сильные, средние и слабые формы антигенов. Эритроциты, несущие эти формы, обычно не имеют качественных различий, но отличаются от образца к образцу степенью агглютинабельности. Выраженность агглютинации (агглютинабельность) определяется количеством антигена, представленного на поверхности эритроцитов, что обусловлено генетическими факторами. Агглютинабельность эритроцитов людей с генотипом cDE/cDE выражена сильнее, чем эритроцитов лиц с генотипом CDe/CDe, поскольку количество антигенных участков на эритроцитах DE больше, чем на эритроцитах DC. Редкий фенотип -D-, при котором отсутствуют антигены С, Е, с и е, отличается наиболее высоким содержанием субстанции D по сравнению с нормальным D-типом. Менее всего антиген D выражен на эритроцитах со слабым D-фенотипом (Du) и совсем не выражен на эритроцитах Rhnull.
В редких случаях варианты агглютинабельности могут быть обусловлены качественными различиями парциальных антигенов, которые содержат неполный набор D-эпитопов.